re从零开始的化学生活
肯定有误,感谢指正
因为本人一点也不想学whk,所以很可能瞎写
物质分类及转化
游离态:元素以单质形式存在的状态(
化合态:元素以化合物形式存在的状态(
同素异形体:同种元素形成的不同单质
- 原子个数不同(
- 原子排列方式不同(金刚石,石墨,:白磷,红磷,:白锡(有延展性),灰锡(粉末状)温度低时变为灰锡
同素异形体之间的性质差异主要体现在物理性质上,同素异形体之间的转化属于化学变化
氧化物:氧元素和另外一种化学元素组成的二元化合物
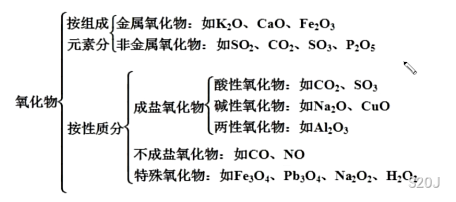
成盐氧化物:可以通过化学反应从氧化物转变成盐
酸性氧化物:可以和碱反应,生成一种盐+水
碱性氧化物:可以和酸反应,生成一种盐+水
两性氧化物:可以和酸和碱反应,生成一种盐+水
:化合价有,生成两种盐
过氧化物:还会生成氧气
酸性氧化物不一定是非金属氧化物
关于(非)金属氧化物与酸(碱)性氧化物:
唯一正确:碱性氧化物一定是金属氧化物
分散系和胶体
被分散成粒子的物质叫做分散质,另一种物质叫做分散剂
根据分散质例子直径大小分类:
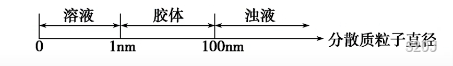
雾:液态小水滴被空气分散
烟:固体小颗粒被空气分散
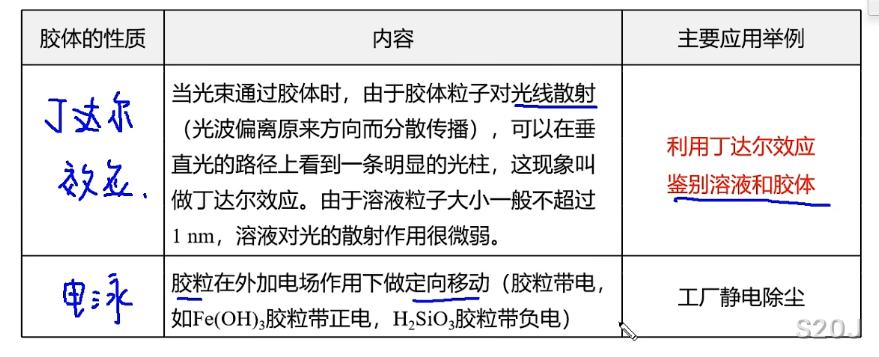
胶体处于介稳体系,可以通过滤纸,不可以通过半透膜
例子: 胶体,豆浆
胶体的制备:
\ce{FeCl_3 + 3H_2O->[加热]Fe(OH)_3(胶体) + 3HCl}
\ce{Fe^3+ + 3H_2O->[加热]Fe(OH)_3(胶体) + 3H+}
至红褐色停止加热
制备时要用蒸馏水,自来水中离子会使胶体沉淀,不能使用玻璃棒
胶体性质:

电解质
在水溶液或熔融状态下能够导电的化合物是电解质
电解质和非电解质都是化合物
有些化合物水溶液能导电,但溶液中的离子不是该化合物自身所电离产生的,所以属于非电解质(等
电解质和溶解性没有关系(
电离:电解质溶于水或受热熔化时,形成自由移动离子的过程
强电解质:在水溶液(熔融状态)能完全电离的电解质
- 强酸:
- 强碱:
- 大多数盐:
- 活泼金属氧化物:
纯水是极弱的电解质
电解质的强弱与溶液的导电性没有必然关系,强弱取决于溶液中自由移动的离子浓度
离子方程式

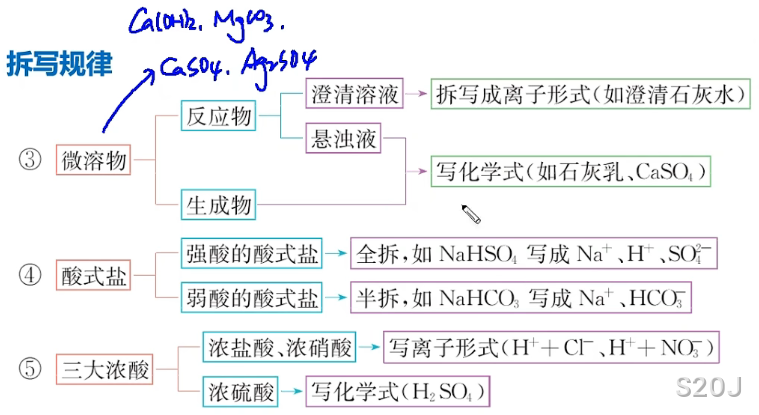
拆:
能拆写成离子的物质必须同时具备易溶,易电离这两个条件
单质,氧化物(,气体,难溶物(,弱电解质
摆了只放截图吧
离子共存
当溶液无色时,有色离子不会大量共存
:蓝色
:浅绿
:蓝色
:紫色
: 黄色
:橙色
透明溶液 无色溶液
溶液呈酸性时,与 反应的离子无法大量存在
与 反应: 和弱酸根离子,即除了 的酸根离子
溶液呈碱性时,与 反应的离子无法大量存在
与 反应: 和与氢氧根形成沉淀的金属阳离子,即除了 的金属阳离子
无论强酸性还是强碱性都无法大量共存的离子
弱酸的酸式根离子(
常见的难溶物/微溶物
好多呀继续开摆

离子间发生氧化还原反应不共存

氧化还原
氧化反应:失 化合价升高
还原反应:得 化合价降低
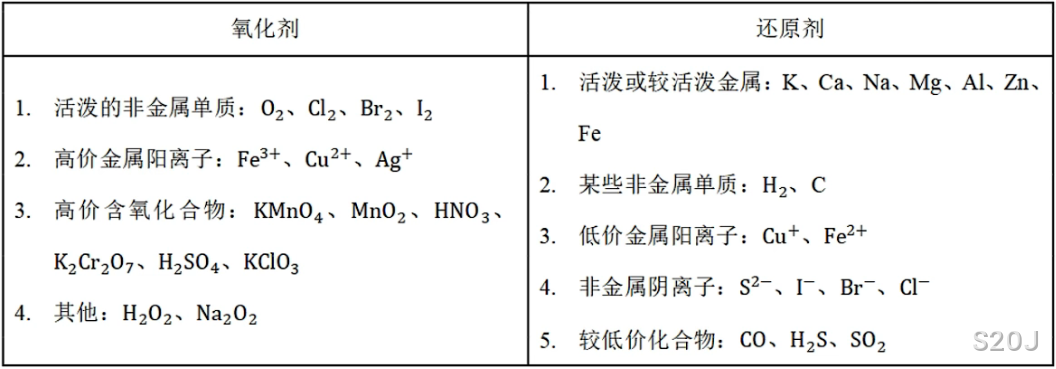
氧化剂:帮助别人氧化的物质,本身被还原,得
还原剂:帮助别人还原的物质,本身被氧化,失
抗氧化剂:很容易被氧化
氧化性:物质得 能力 ,氧化剂强弱
氧化性:物质失 能力 ,还原剂强弱
氧化产物:被氧化所生成的产物
还原产物:被还原所生成的产物
常见氧化剂与还原剂
若元素处于最高价态,则只表现氧化性(的 , 的
若元素处于最低价态,则只表现还原性(
处于中间价态都可以(
电子转移的表达方式
双线桥法
表示同一元素反应前后变化

单线桥法
表示反应物之间的电子转移
 ****
****
氧化还原反应的强弱规律
氧化性:氧化剂 氧化产物
还原性:还原剂 还原产物
越强的氧化剂变成的还原产物还原性越弱
当有一氧化剂(还原剂)和多种还原剂(氧化剂)时,还原剂(氧化剂)强的先反应
还原性顺序(被氧化顺序):
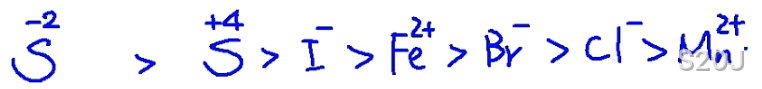
不会再字母头上写东西只能截图
留(硫)一点(碘)铁(铁)生锈(溴)长绿(氯)毛(锰)
价态归中规律和歧化规律
价态归中规律:同种元素不同价态之间发生反应,元素的化合价只向中间靠拢而不交叉
歧化规律:同一物质,同一价态,同一元素,既被氧化又被还原的反应
歧化反应的特点是氧化剂和还原剂是同一种物质
氧化还原方程式
反正我少学一点没人知道
钠
密度
熔点低于100°C
质地柔软,轻压变形,可以用小刀切割
具有很强的还原性
(失去金属光泽)
\ce{2Na + O2->[加热]Na2O2}(淡黄色)
\ce{Na->[O2]Na2O->[H2O]NaOH->[CO2]Na2CO3·10H2O->Na2CO3}
钠单质与水反应:
实验:将绿豆大的钠放入水中
现象:浮(密度小),熔(熔点低,反应放热),游(生成 ),响(生成 ),红(生成 )
钠单质与盐溶液的反应:
先跟水反应
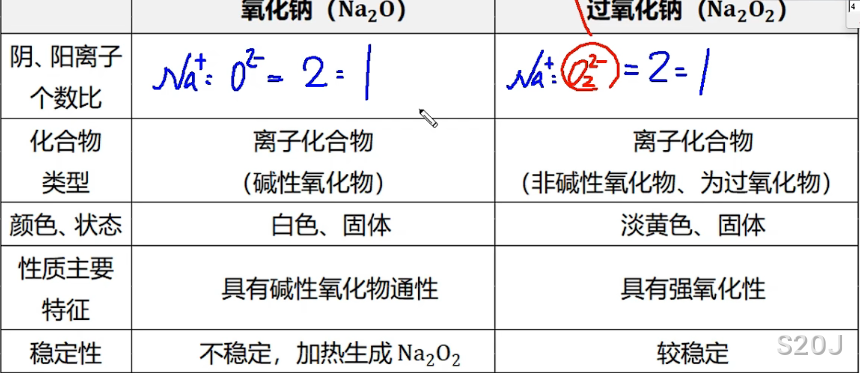
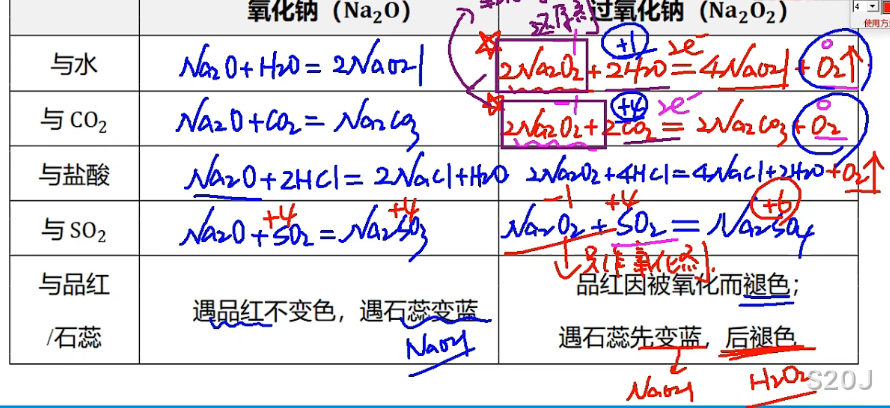
氧化钠与过氧化钠比较
过氧化钠是过氧根离子